A Inteligência Artificial (IA) tem sido alvo de estudos em diversas áreas e seu uso na área de saúde vem crescendo exponencialmente. O desenvolvimento de sistemas que auxiliem em uma conduta clínica mais assertiva é cada vez mais estudado em diversas frentes.
A capacidade de uma tecnologia receber informações, ponderá-las e tomar decisões a partir dessas informações, pode ser muito relevante em diversos aspectos, inclusive na predição à resposta à diferentes tratamentos de saúde. Sistemas de IA podem atualmente receber e interpretar informações clínico-patológicas sobre os pacientes e, assim, identificar possíveis desfechos baseados em casos de exemplos passados, como um aprendizado sobre o assunto.
A padronização de um modelo de predição baseado em IA para pacientes com diferentes doenças pode auxiliar na conduta clínica de maneira personalizada e mais assertiva. Em nosso estudo objetivou-se aplicar modelos de IA para predizer a resposta à QTNA baseado somente em dados clinico-patológicos.
Com relação ao câncer de mama, por exemplo, especificamente, observa-se, atualmente, estudos focados na interpretação de exames de imagem. Entretanto, quando se trata de quimiorresistência e quimiossensibilidade, há pouquíssimos dados publicados, sendo que, até o momento, não existem trabalhos que demonstrem uma predição com base exclusivamente em dados clínico-patológicos. Por isso, destaca-se a inovação do presente estudo e sua relevância científica.
A IA tem como princípio básico a formação de modelos cognitivos que tenham capacidade de interpretação de dados e previsão dos mesmos. A interpretação das informações ocorre a partir do conhecimento adquirido. Na concepção da ciência da IA, “conhecimento” representa dados. Para a simulação de modelos cognitivos desenvolve-se uma rede neural artificial (RNAs), a qual simula um neurônio biológico. Em um neurônio humano há regiões específicas, dentre elas: dendritos, especializados em recepção de impulsos nervosos; e corpo celular, um local de processamento de informações e terminações nervosas, responsáveis pela saída do impulso nervoso.
Uma RNA apresenta regiões muito semelhantes. Os dendritos neurais são representados pela letra “w” na figura abaixo, na qual destaca-se a existência de mais de um prolongamento neural. Ou seja, mais informações recebidas, sendo cada uma com pesos diferentes e determinantes para uma boa interpretação de dados. O corpo celular é interpretado pelas letras “fa” na figura abaixo. Neste local da RNA ocorre a combinação pelo meio de função matemática dos dados obtidos em “w” e, por fim, as terminações nervosas, nas quais ocorre comunicação entre as RNA’s, simulando uma sinapse neural.
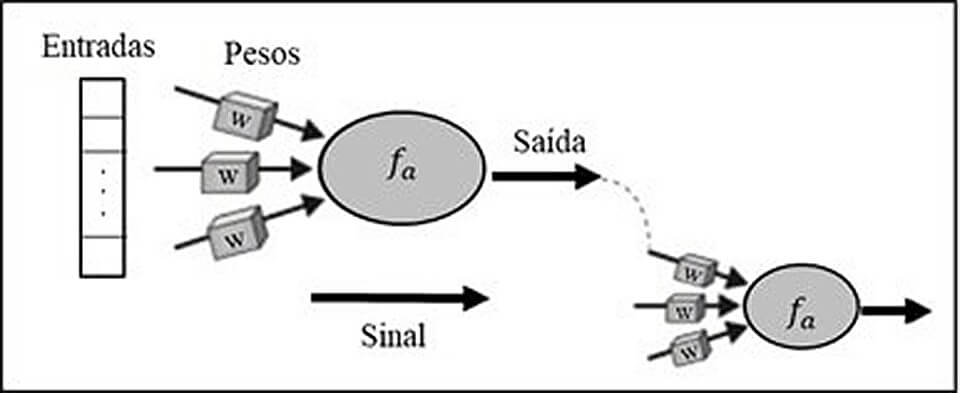
Quando se investigou o uso específico de RNA, com seu modelo de aprendizado e suas relações com o câncer de mama, evidenciou-se alguns estudos focados em predição do risco de câncer de mama e sua progressão. Porém, até o momento, não há trabalhos que utilizem dados clínico-patológicos na predição da resposta quimioterápica em pacientes com câncer de mama, mais uma vez destacando a importância do presente trabalho para o aprimoramento científico na área.
Considerado a habilidade de adaptação, capacidade de aprendizado por meio de exemplos, organização de dados e reconhecimento de padrões, as RNAs podem ser consideradas como modelos computacionais e tornam-se uma interessante ferramenta para predição de resposta quimioterápica, recidiva locorregional, progressão sistêmica da doença e sobrevida no caso do câncer de mama.
Referências bibliográficas
- Sancho-Garnier, H. and M. Colonna, [Breast cancer epidemiology]. Presse Med, 2019. 48(10): p. 1076-1084.
- Ahmed, S.H., Safety of neoadjuvant chemotherapy for the treatment of breast cancer. Expert Opin Drug Saf, 2019. 18(9): p. 817-827.
- Li, X., et al., Predictive and Prognostic Roles of Pathological Indicators for Patients with Breast Cancer on Neoadjuvant Chemotherapy. J Breast Cancer, 2019. 22(4): p. 497-521.
- Sparano, J.A., et al., Clinical and Genomic Risk to Guide the Use of Adjuvant Therapy for Breast Cancer. N Engl J Med, 2019. 380(25): p. 2395-2405.
- Audeh, W., et al., Prospective Validation of a Genomic Assay in Breast Cancer: The 70-gene MammaPrint Assay and the MINDACT Trial. Acta Med Acad, 2019. 48(1): p. 18-34.
- Carter, S.M., et al., The ethical, legal and social implications of using artificial intelligence systems in breast cancer care. Breast, 2020. 49: p. 25-32.
- Ibrahim, A., et al., Artificial intelligence in digital breast pathology: Techniques and applications. Breast, 2020. 49: p. 267-273.
- Lee, C.I., et al., Pathways to breast cancer screening artificial intelligence algorithm validation. Breast, 2020. 52: p. 146-149.
- CARVALHO, A., et al., Inteligência Artificial–uma abordagem de aprendizado de máquina. Rio de Janeiro: LTC, 2011.
- Díaz-Casas, S.E., et al., Pathological Response to Neoadjuvant Chemotherapy and the Molecular Classification of Locally Advanced Breast Cancer in a Latin American Cohort. Oncologist, 2019. 24(12): p. e1360-e1370.
- Asaoka, M., et al., Clinical and pathological predictors of recurrence in breast cancer patients achieving pathological complete response to neoadjuvant chemotherapy. Eur J Surg Oncol, 2019. 45(12): p. 2289-2294.
- Del Prete, S., et al., Clinical and pathological factors predictive of response to neoadjuvant chemotherapy in breast cancer: A single center experience. Oncol Lett, 2019. 18(4): p. 3873-3879.
- Mamounas, E.P., et al., Predictors of locoregional recurrence after neoadjuvant chemotherapy: results from combined analysis of National Surgical Adjuvant Breast and Bowel Project B-18 and B-27. J Clin Oncol, 2012. 30(32): p. 3960-6.
- Gillon, P., et al., Factors predictive of locoregional recurrence following neoadjuvant chemotherapy in patients with large operable or locally advanced breast cancer: An analysis of the EORTC 10994/BIG 1-00 study. Eur J Cancer, 2017. 79: p. 226-234.
- Li, Y., et al., Incidence, risk factors and survival of patients with brain metastases at initial metastatic breast cancer diagnosis in China. Breast, 2020. 55: p. 30-36.
- Howlader, N., et al., SEER cancer statistics review. National Cancer Institute, 1975. 2008.
- Park, K., et al., Robust predictive model for evaluating breast cancer survivability. Engineering Applications of Artificial Intelligence, 2013. 26(9): p. 2194-2205.
- Le, E.P.V., et al., Artificial intelligence in breast imaging. Clin Radiol, 2019. 74(5): p. 357-366.
- Wu, G.G., et al., Artificial intelligence in breast ultrasound. World J Radiol, 2019. 11(2): p. 19-26.
- Rodríguez-Ruiz, A., et al., Detection of Breast Cancer with Mammography: Effect of an Artificial Intelligence Support System. Radiology, 2019. 290(2): p. 305-314.
- Yin, X.X., et al., Artificial Intellegence in Breast MRI Radiogenomics: Towards Accurate Prediction of Neoadjuvant Chemotherapy Responses. Curr Med Imaging, 2020. 25(10): p. 1573405616666200825161921.
- Ayer, T., et al., Breast cancer risk estimation with artificial neural networks revisited: discrimination and calibration. Cancer, 2010. 116(14): p. 3310-21.
- Dihge, L., et al., Artificial neural network models to predict nodal status in clinically node-negative breast cancer. BMC Cancer, 2019. 19(1): p. 019-5827.
- Sepandi, M., et al., Assessing Breast Cancer Risk with an Artificial Neural Network. Asian Pac J Cancer Prev, 2018. 19(4): p. 1017-1019.
- Zhang, Z., et al., Morphology-based prediction of cancer cell migration using an artificial neural network and a random decision forest. Integr Biol, 2018. 10(12): p. 758-767.
- Motalleb, G., Artificial neural network analysis in preclinical breast cancer. Cell J, 2014. 15(4): p. 324-31.





